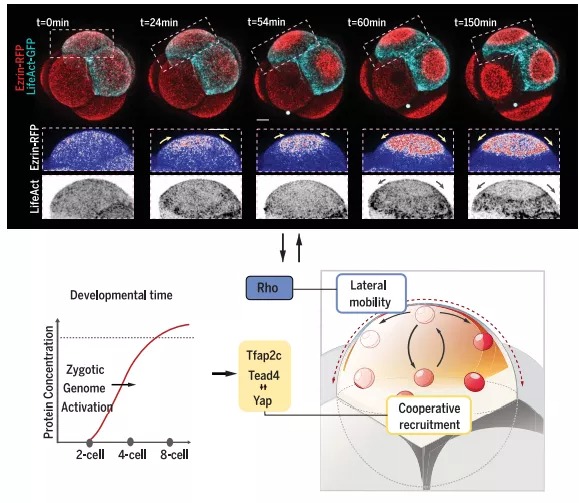
2020年12月剑桥大学生理学、发育和神经科学系 Magdalena Zernicka-Goetz教授于Science发表文章Developmental clock and mechanism of de novo polarization of the mouse embryo,其研究确定了在小鼠胚胎中重新建立细胞极化所必需的和充分的分子,表明ZGA在调节细胞极化的时间上起着直接作用。除了确定足以建立细胞极化的关键分子外,作者还提供了对这些分子在哺乳动物胚胎中建立细胞极化的机制的生物物理理解。
在着床前发育过程中,顶基细胞极性的建立是全能性向多能性转化的关键,诱导细胞向滋养外胚层分化。在小鼠胚胎中,这一事件被编程为发生在8-细胞阶段,并且这个时间安排遵循一个内在的发育时钟,该时钟与胚胎大小或细胞周期进程无关。尽管顶端区域的形成很重要,但在小鼠和人类胚胎中建立细胞极化的分子机制和这一事件的时间调节在很大程度上仍然难以捉摸。
胚胎极化是ICM和TE谱系分离的关键。在小鼠中,这一过程发生在8细胞阶段,此时每个卵裂球获得一个顶端结构域,包括PAR蛋白复合物和被肌动球蛋白环包围的ERM蛋白。顶端结构域能够表达转录因子,如Cdx2和GATA3,这些转录因子推动分化为TE,而脱脂细胞保持多能性,成为ICM。
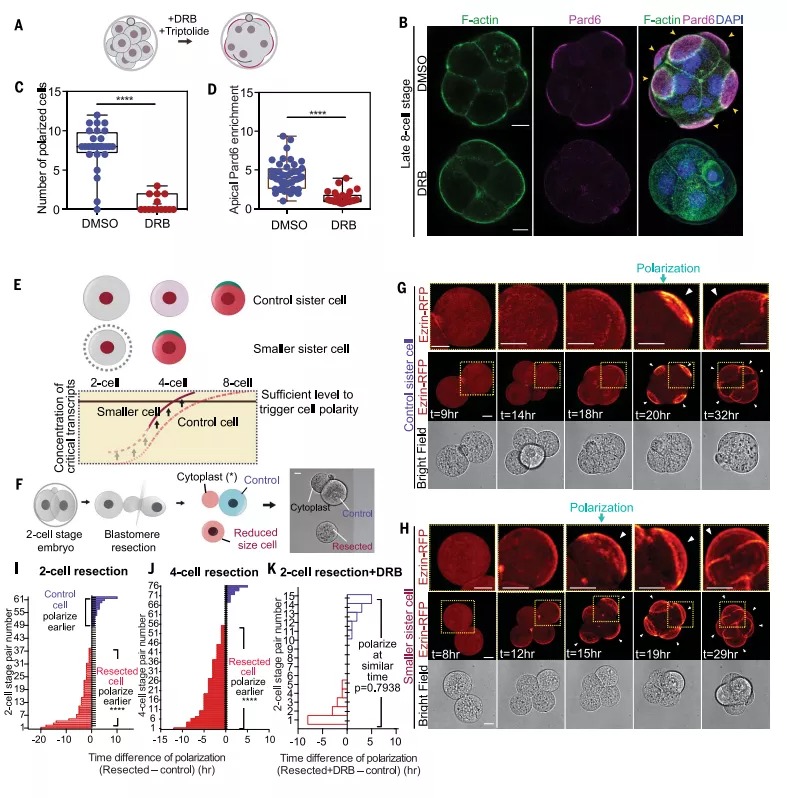
图1:两极分化对新生转录本的依赖
哺乳动物胚胎的发育是有调节的,但即使胚胎分裂成单独的卵裂球,当细胞聚集在一起,或者当细胞分裂被阻止时,胚胎极化的时间也保持不变。因此,极化似乎被设定为一个严格的发育时钟,与细胞数量无关。时钟反映了合子基因组的激活,研究人员确定了三个因子,它们的收敛活动触发了顶端结构域的自组织。胚胎极化所需转录本的临界阈值。不同物种的极化时间不同,反映合子基因组激活(ZGA)的开始。在小鼠中,ZGA的主要波出现在两细胞阶段,但另外一个转录波也出现在八细胞阶段的早期,恰好在极化之前。
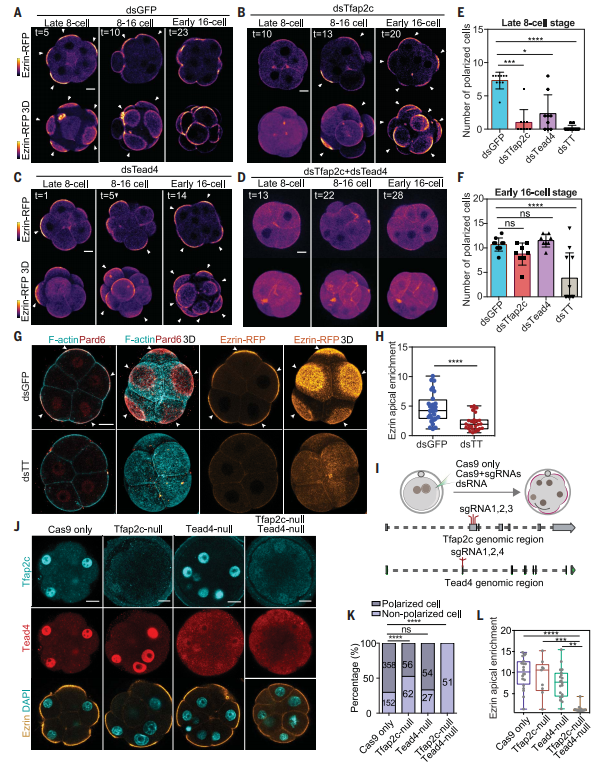
图2:Tfap2c的合子表达而茶对于极化是必不可少的。
在哺乳动物的发育中,第一次出现顶端-基底细胞极性的重要性从它对触发第一次细胞命运多样化事件的要求中可见一斑。在这里,研究人员表明Tfap2c和Tead4的合子表达是这种极化的先决条件。研究人员已经能够通过驱动Tfap2c、Tead4和激活的Rho GTP酶的异位表达来诱导性早熟胚胎极化,从而促进随后的胚胎发育。研究人员的发现有助于解释合子基因组激活和多个哺乳动物物种胚胎极化建立之间的时间关系。
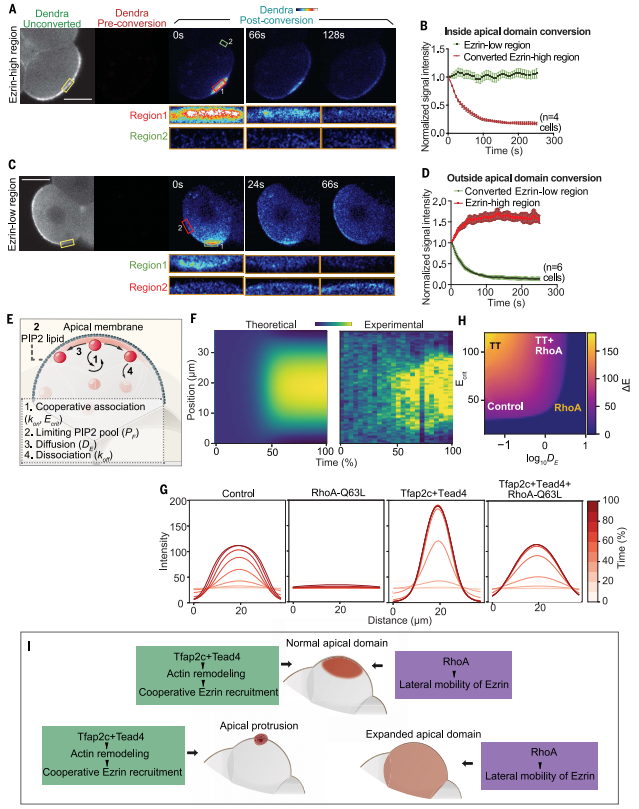
图6:Tfap2c、Tead4和RhoA通过正反馈和移动系统调节顶端结构域的形成。
8-细胞期的胚胎极化一直被视为上皮极化的模型。然而,顶区的形成与许多其他类型的细胞不同,因为它可以在没有外部信号的情况下发生,例如细胞外基质或细胞粘附。这种独特的自发对称破缺特性背后的机制仍然难以捉摸。在这里,研究人员表明对称性破坏的第一步是顶端蛋白通过它们在膜上的两种行为集中:肌动蛋白介导的协同募集和横向移动。这两个过程起到相反的作用,调节顶端结构域的形状;合作的招募机制使顶端蛋白能够打破对称和集中,而横向迁移性允许顶端蛋白扩散,从而建立新月形的补丁(图6,G和H,图3)。这两个过程之间的平衡活性确保了顶端结构域的正确形状,因为过度的合作招募力量会导致小的且往往是多个结构域,而过度的横向迁移率会导致顶端蛋白质的均匀分布,从而抑制对称破坏(图6G和图6G)。
研究人员的结果表明,合作招募受到Tfap2c和Tead4控制的肌动蛋白重塑的调节。虽然详细的机制超出了本工作的范围,但有可能Ezrin在类似于蛋白质缩合的过程中优先招募到由Arp2/3复合物促进的肌动蛋白结构中。在这种情况下,分支肌动蛋白网络的密度会对Ezrin在合作招募过程中的饱和程度产生积极的影响。在体外观察到,Arp2/3活性形成的肌动蛋白簇被高水平的皮质肌球蛋白降解,这可以解释这两个转录因子与RhoA在调节顶端蛋白簇从而调节顶端结构域形状方面的相反作用。
研究人员描述的调控机制是基于Ezrin的行为,它很可能适用于其他顶端蛋白,如PAR复合体,它们的极化动态高度相似,也需要肌动蛋白网络和膜结合,这是研究人员描述的过程的关键条件。研究人员的工作阐明了胚胎如何在特定发育阶段在阶段依赖通路的调控下建立细胞极化。研究人员的结果也为极化是如何建立的提供了生物物理解释,表明正反馈结合横向迁移率足以驱动这种自组织过程。因此,这些结果为小鼠胚胎中建立从头极化的时机和机制提供了洞察力,这是第一次确定细胞命运的关键事件。
原文链接:https://doi.org/10.1126/science.abd2703













